При изготовлении радиолампы есть всего две сложности, два критических места.
Одно из них — изготовление катода электронной лампы, который должен отдавать электроны…
Собственно, вся электронная лампа стоит на явлении термоэлектронной эмиссии — то есть на том, что сильно нагретые тела начинают излучать электроны. При этом вылет электронов обусловлен колебаниями узлов атомарной решетки, поэтому из расплава электроны вылетать не будут, а только из твердого тела и желательно кристаллического.
Самым простым веществом, от которого можно получить термоэлектронную эмиссию, является вольфрам.
Он отдает электроны не слишком охотно, но он стабилен и отлично работает даже в плохих вакуумных условиях. Главный его недостаток, что его рабочей температурой является 1900 — 2500°С.
Собственно, если металлургия развилась настолько, что доступен вольфрам — то электронные лампы будут работать. Да и работали много лет, пока не были изобретены энергетически более выгодные катоды. Собственно почему «пока»? Более энергетически выгодные катоды — это те же вольфрамовые, но со специальными покрытиями. А в некоторых типах ламп до конца использовались чистые вольфрамовые.
В нашем мире вольфрам был получен в конце 16 века, но, конечно, промышленное использование подзадержалось.
Вольфрам — это единственное решение при массовом производстве ламп, хотя нормальные катоды получаются и из тантала, или ниобия.
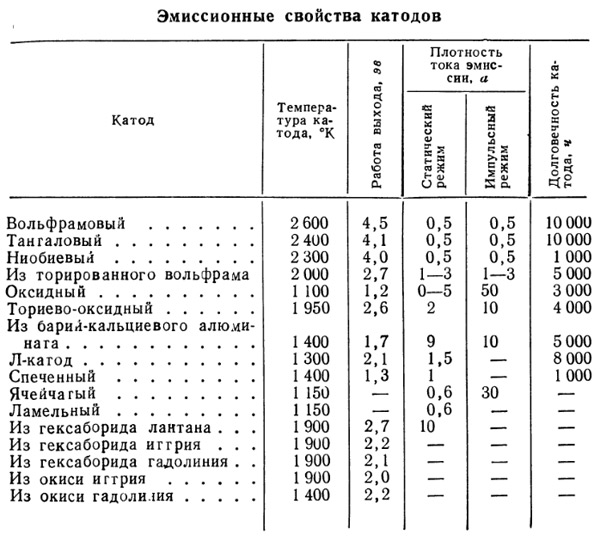
Все остальные 50 лет развития электронных ламп ушли на улучшение двух параметров — уменьшения энергии выхода электронов и уменьшения рабочей температуры катода. Решений тут за эти годы накопилась гора.
Например, для катодов прямого накала использовались пленочные катоды — когда вольфрам покрывался пленкой другого металла, чаще всего — тория.
Для катодов косвенного накала чаще всего использовали оксидные катоды. То есть катод покрывали солями щелочноземельных солей (обычно углекислых солей — карбонатов бария, кальция и стронция). Для этого проволоку, из которой делается катод, протягивают через суспензию этих солей, к которой добавляют специальное органическое вещество — биндер, связывающее частицы покрытия с поверхностью металла. При первом нагревании катода биндер выгорает.
Также оксидный катод можно наносить катафорезом — погружая в суспензию и подавая отрицательный электрод, получается некоторое подобие гальванопластики.
Но покрытие это очень и очень нежное. В конце концов стало широко распространятся опрыскивание катодов при помощи специальных пульверизаторов.
Но кроме прочего оксидный катод нужно активировать — нагреть в вакууме до температуры, выше рабочей на 300-350°С, при этом карбонаты покрытия частично разлагаются и появляется свободный барий. При этом такой катод — очень хрупкая штука. Его рабочая температура порядка 850°С и перегревать нельзя.
Можно представить, какие ухищрения применялись, чтобы использовать такие вот нежные катоды, а они были самые массовые из-за дешевизны материалов. Поэтому пытались использовать спеченные катоды. На металлическую подложку наносился тончайший слой никелевого порошка и спекался с ней в атмосфере водорода. Потом, как всегда — погружаем в соли. Такой катод имеет бОльшую активную поверхность. Ведь срок службы таких ламп зависит от того, насколько быстро испарится активное покрытие.
На этом прогресс не остановился. Появились хитрые Л-катоды с молибденовым цилиндром и вольфрамовой губкой, внутри которого запас активного вещества (барий и стронций), импрегнированные, полые, ячеистые и ламельные катоды.
В любом случае — все эти хитрые катоды со временем теряют эмиссию и лампа «садится». Это и хорошо и плохо. Ламповую аппаратуру легко поддерживать в рабочем состоянии и она не ломается мгновенно — но она потихоньку теряет свои рабочие характеристики. В отличии от нее транзисторы любят выходить из строя мгновенно, но до самого конца держатся молодцом.
В общем, если есть вольфрам — можно пытаться строить лампы.
Однако, хотя вольфрам очень желателен, попаданцу можно обойтись и без него.
В этом случае катод делается из платины.
Платина имеет свойства похуже, чем вольфрам. Она плавится при 1772°С (а чем выше температура, тем мощнее термоэлектронная эмиссия). Один плюс — сопротивление его в два раза больше и проволочки катода можно делать не настолько тонкими, что технологически проще.
Но и сама эмиссия у платины хуже, чем у вольфрама.
Можете сами полюбоваться на табличку сравнения свойств разных металлов:

Тут температуры плавления металлов обозначены концами линий.
Видно, что платина в этом списке — наихудший вариант.
Но не это самое плохое.
Дело в том, что если возьмем вольфрам, то у него работа выхода — 4.51 электрон-вольт. А у платины этот параметр может колебаться от 2.18 и 6.71 V, и если первое число — просто великолепно, то второе хуже некуда. Разброс гигантский. Это связано с тем, что поверхность платины неуправляемо адсорбирует кислород, и в реальном мире конструкторы так и не смогли управлять этим процессом.
Для попаданца это значит, что лампа будет не только иметь разные коэффициенты усиления и сможет пропускать разные токи. Будут сдвигаться графики вольт-амперных характеристик лампы и лампа будет «открываться» и «закрываться» при разном напряжении. То есть если лампа сгорела, то невозможно будет просто выкинуть нерабочую лампу и воткнуть новую. Придется перерабатывать всю схему — менять и конденсаторы и резисторы. То есть каждая лампа будет иметь свои номиналы в схеме.
Конечно, в массовом производстве это все можно попробовать и побороть. Например, разделить все лампы на шесть или восемь классов и каждую лампу прогонять на тестах и маркировать определенным классом. Однако, это задача непростая, требует очень много времени и главное — квалифицированного труда.
Но несмотря на все — простые катоды из платины возможны. Ведь платина только сравнительно недавно стала дорогим металлом, в свое время даже название «платина» («серебришко») она получила за то, что только похожа на серебро, но применения ей нет. Ее даже поначалу выбрасывали в рудные отвалы.
Поэтому если попданцу доступен вольфрам — то лучше использовать его, а если нет, то и платина сойдет…

Тот же эдисон открыл эффект на лампе с платиновым электродом. Платину во многих местах и временных периодах получить попроще чем вольфрам — она получалась при добыче традиционных драг металлов, но ее считали бесполезным металлом.
C платиновым катодом было немного не так.
Это произошло только в 1903 году и это был не Эдисон, а Венельт.
Он проводил эксперименты с платиновым катодом примерно при 900°С. При такой температуре платина вообще ничего не выдает из электронов. Но тут вдруг обнаружилось, что некоторые кусочки катода имеют очень даже неплохую эмиссию. Выяснилось, что это из-за примесей редкоземельных элементов и платина тут вообще не при чем.
Собственно, использование редкоземельных элементов в катодах и началось после этого.
Тут есть парочку «но».
Сама платина, хоть и тугоплавкая, но как катод она ниже плинтуса. Вот даже в таблицу не попала.
А примеси — они могут быть, а могут и не быть. А если есть — то очень быстро выгорают и идет потеря эмиссии. И редкоземельные элементы получать как бы посложнее, чем вольфрам. И кроме того — если в платину добавить эти все элементы, то из нее будет сложно сделать тончайшую проволоку для нити накаливания, и вместо 6 вольт накаливания придется валить все 40. Соответственно — греться будет здорово.
Поэтому я скептически отношусь с платиновым катодам.
Хотя как демонстратор технологии это может сойти.
И еще — возможно получится с платиновым электродом, покрытым карбонатом кальция (это тот мелок, чем пишут на школьной доске).
Но в реальности платина вообще не применялась.
И я не знаю почему.
То ли температура плавления слишком низкая — всего 1772°С, то ли электрическая проводимость слишком низкая (в два раза ниже, чем у вольфрама), то ли к ней не липнет никакое покрытие (благородный металл все-таки). А может быть — проблемы с производством тонкой проволоки.
То, что она не лучше вольфрама и дороже — это понятно. Но странно, что вообще нигде не использовалась.
Эдисон в патенте указал именно платину.
вики:
Although thermionic emission was originally reported in 1873 by Frederick Guthrie, it was Thomas Edison’s 1884 investigation that spurred future research, the phenomenon thus becoming known as the «Edison effect».
http://www.google.com/patents?vid=307031
В конце 19 века вокруг валялось много всего нового а юзать не умели. На лампочки например тантал и осмий(!) юзали. Победил вольфрам и про извращения все забыли.
Но хорошо бы все таки найти альтернативу вольфраму, а то черт его знает где его копать в Мезоамерике 🙂
Оу, спасибо! Очень интересно почитать патент, тяжело продраться через всякие «set forth». И непонятная схема с двумя диодами, один которых подключается выключателем.
И самое главное — непонятно, то ли платина сама может при высоких температурах давать эмиссию (как вольфрам) или это опять примеси, которые быстро выгорают и плохо контролируемые.
Надо поискать все же данные по катоду из платины, а вдруг он вполне юзабелен — ну, там энергия выхода больше и еще что по мелочи.
Тогда вполне возможно электронную лампу откатить еще на пару сотен лет в прошлое, потому что с вольфрамом проблем поболее, чем с вакуумом.
И, кстати, тантал вполне неплохая замена вольфраму, тантал даже предпочтителен.
А в Мезоамерику ехать за вольфрамом незачем. Он и найден-то был в Саксонии. Но найти руду и получить металл — две большие разницы…
Нашел у Чеффи!
Действительно, кой-какие перспективы у платинового электрода есть.
Вот такой вот график:
Тут по осям отложены логарифмы, поэтому черт ногу сломит.
Но эмиссию можно оценить. Концы линий — это точки плавления металлов.
И нашел почему платина не использовалась.
Во-первых: «Измеренные значения параметров эмиссии платины колеблются в широких пределах, вероятно вследствие невозможности получить чистую поверхность, не загрязненную адсорбированным кислородом.»
Дальше в обсуждении работы выхода: «Платина, по-видимому отступает от нормы, поскольку константы эмиссии этого металла, согласно измерениям различных авторов, изменяются более резко, чем у других металлов. Дю-Бридж составил таблицу значений для платины, величина электронного сродства колеблется между 2.18 и 6.71 V, значение же А от 10.7 х 10-4 до 1.45 х 107. Эти значительные колебания, по-видимому, обусловлены окклюдированным кислородом, который (согласно наблюдением Лэнгмюра) чрезвычайно быстро конденсируется на чистой платине.»
Как я понимаю, просто не удалось получить гарантированный результат с платиной. У вольфрама работа выхода 4.51, а тут разброс от 2.18 до 6.71! Это просто космические вариации!
То есть в случае попаданца для каждой электронной лампы с платиновым катодом прямого накала — придется собирать свою схему со своими номиналами. Никакого производства не получится и если лампа сдохнет, то схему надо переделывать, просто заменить лампу не выйдет. Очень геморройно, но возможно.
Завтра отрихтую статью.
Замечательно. Отлаживание каждой лампы, конечно геммор, но от процесса получения чистого вольфрама глаза на лоб вылезают 🙂
У Эдисона был катод из угольной нити. Это была просто лампочка накаливания с угольной нитью + доп электрод в лампе.
>>>Самым простым веществом, от которого можно получить термоэлектронную эмиссию, является вольфрам.
Самым простым веществом для катода является угольная нить. Она вполне пригодна, но температура требуется как у нити лампочки накаливания.
Собственно — диод Эдисона именно так и был устроен, это была лампочка накаливания с угольной нитью + доп электрод в колбе.
Понятно что у угольной нити накаливания ресурс не очень — серийные лампочки накаливания Эдисона имели ресурс в 600 часов, но и это вовсе не так уж плохо.
А что может произойти с угольным покрытием (угольной нитью) в условиях высокого вакуума?
Кстати да, как катод углерод много более привлекателен чем платина. Как по работе выхода так и по рабочей температуре. К, лову ток катода очень быстро растёт с ростом температуры.
И испаряется углерод также весьма неохотно.
Вот хрупкость…