Натрий и калий были открыты в самом начале XIX в., когда из смог выделить в свободном состоянии Гемфри Деви при электролизе растворов едких щелочей с ртутным катодом. Электролиз, но уже расплавов хлоридов, является методом их получения и в наше время.
Однако для попаданца больший интерес представляет возможность получения щелочных металлов термохимическим методом, как они и производились на протяжении почти всего XIX века.
Образование натрия при накаливании соды с углем или железом наблюдали Гей-Люссак, Тенард и многие другие, но основной вклад в развитие технологии производства натрия внес Сент Клер Девиль, которому натрий был необходим для получения алюминия.
По методу Девиля смесь 30 кг соды, 13 кг угля и 5 кг мела помещалась в трубу из железа (примерно 120 на 15 см со стенками в 12-15 ми) и нагревалась в печи до белого каления
Na2CO3 + 2C = 2Na + 3CO

При этом происходило восстановление натрия, который испарялся (температура кипения 882 градуса), конденсировался в специальном железном холодильнике, и стекал в подставленный сосуд с маслом или нефтью для зашиты от действия воздуха.
Перегонка длилась несколько часов, после чего остаток из реторты быстро удаляли и загружали новую порцию смеси. Из одной загрузки получалось около 5 кг натрия.
Аналогично получался и калий из поташа, но при этом процесс осложнялся взаимодействием калия с CO, при котором образовывались K2C2 и K6C6O6.
Метод Девиля был далек от совершенства, выход натрия не превышал 40%, железные реторты очень быстро прогорали, и расход на их замену составлял до половины стоимости производимого натрия (на 1887 г около 11 шиллингов за килограмм). Тем не менее, стоимость получаемого с помощью натрия алюминия сразу же уменьшилась более чем в 20 раз.
Еще более совершенный метод разработал Кастнер, тоже занимавшийся проблемой получения алюминия. По его методу едкий натр смешивался с карбидом железа FeC2 (который, в свою очередь, получался прокаливанием железной руды со смолой или угольным порошком), и нагревался в чугунном тигле, снабженном крышкой и газоотводной трубкой.
4NaOH + FeC2 = 2Na + Na2CO3 + Fe + 2H2 + CO
При этом требовалась меньшая температура, не более 1000 градусов, поэтому реакцию проводили в дешевых чугунных тиглях, а утилизация натрия, с учетом образующегося карбоната, была практически полной. Стоимость производимого по этому способу натрия получалась около 2 шиллингов за килограмм; производительность печи с тремя тиглями составляла 45 кг натрия в день.
Но метод Кастнера не получил большого распространения, так как тем же Кастнером вскоре был разработан первый практически применимый метод электролитического восстановления.
Самое очевидное для пораданца применение натрия и калия состоит в металлотермическом восстановлении алюминия, магния и других металлов, которые весьма ценны как легирующие добавки и получение которых будет оправданно даже таким относительно дорогим способом. Например, для модифицирования чугуна нужно лишь 1-5 кг магния на тонну, а для раскисления тигельной стали всего 150-500 г алюминия на тонну. Свойства медных сплавов — бронз и латуней — улучшаются при добавках уже 1-2% алюминия, 5-10% достаточно для получения алюминиевой бронзы без других легирующих элементов.
Другая весьма полезная область — получение перекисей. Если сжигать натрий на воздухе, получается смесь оксида и пероксида (20-30%), которая при дальнейшем накаливании до 300-400 градусов поглощает кислород и превращается в чистый пероксид.
4Na + O2 = 2Na2O
2Na2O + O2 = Na2O2
Калий же сразу дает супероксид
K + O2 = KO2
В самом простом варианте натрий сжигался на железной сковороде, но продукт получался с примесями железа, что недопустимо для некоторых целей. Лучший способ состоит в распылении жидкого металла струей воздуха (предварительно очищенного от воды и углекислого газа пропусканием через негашеную известь) в металлической камере достаточного размера, при этом частицы получающихся пероксидов успевают охладиться до падения на дно и не вызывают разъедания железа.
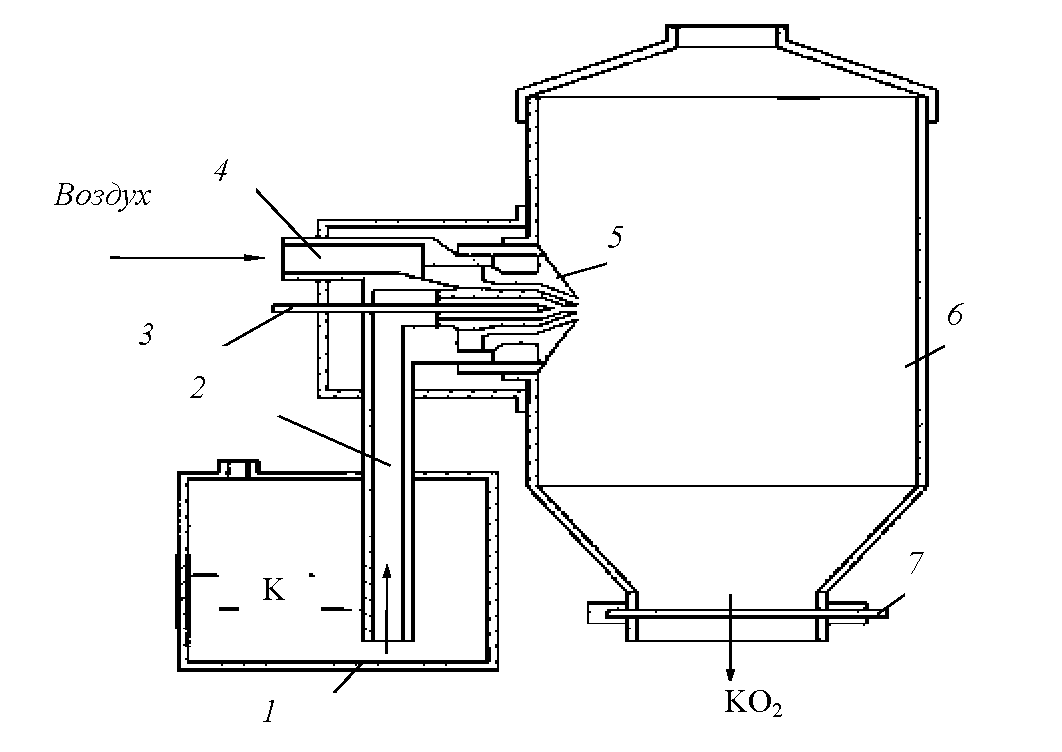
Перекиси натрия и калия при растворении в воде дают щелочной раствор перекиси водорода, пригодный для беления.
Na2O2 + 2H2O = 2NaOH + H2O2
Саму перекись водорода тоже несложно получить из пероксида натрия (не содержащего примесей железа) действием разбавленной кислоты.
Однако самое заманчивое для попаданца применение пероксидов натрия и калия — регегерация воздуха в дыхательных аппаратах или подводных лодках.
Таким образом, и натрий, и калий вполне могут быть получены практически в любых условиях, лимитирующим фактором является только доступность железа. Польза этих металлов для попаданца тоже не вызывает сомнений

Самым главным применением этих металлов будет получение самовоспламеняющихся на воздухе смесей))) И уж потом алюминия, как материала для украшений.
Это первое что приходит в голову… но сразу вспоминается, что в огнемётах и зажигалках 20в самовоспламеняющимися не особо-то увлекались.
Видимо, не оправдывает опасности обращения.
Да бог с ними с украшениями. Алюминиевая бронза и хорошая тигельная сталь намного важнее.
В общем-то да, металлургия поважней бижутерии будет.
В принципе, в ситуации полного отсутствия меди можно и об алюминиевых проводах задуматься.
//На химическом заводе de Haën в Ганновере применяется следующий метод получения перекиси натрия.: азотнокислая соль смешивается с известью и магнезией; смесь сильно накаливается; над полученной таким образом пористой щелочной массой пропускается воздух при 300—500°, кислород которого и переводит окиси в перекиси; извлекая водой, получают в растворе перекись щелочного металла. Удобно готовить в больших количествах перекись и из металла, окисляя его воздухом при 300°//
Весьма интересный вариант. Разложение селитры идет с выделением кислорода и оксидов азота
2NaNO3 = 2NaNO2 + O2
2NaNO2 = Na2O + N2O3
Оксиды азота легко уловить раствором соды, и таким образом вернуть в цикл, расходуя на получение перекиси только соду.
Вроде и неплохо, но насчёт зациклить без потерь… не очень верится, пока Габера не запустили — дорговастенько встанет.
При этом, вся эпопея с селитрой даёт только повышенную дисперсность оксида, чего наверняка можно добиться, прокаливая ту же соду на каком-то носителе.
» Если сжигать натрий на воздухе, получается смесь оксида и пероксида (20-30%), которая при дальнейшем накаливании до 300-400 градусов поглощает кислород и превращается в чистый пероксид. 4Na + O2 = 2Na2O 2Na2O + O2 = Na2O2″
Гм… если мы оксид прокаливаем — не проще гидроксид прокалить и не морочиться с восстановлением и потом окислением обратно?
Эээ, ну вообще даже в школе проходят, что гидроксиды натрия и калия (как и карбонаты) не разлагаются при нагревании. Собственно поэтому их раньше называли постоянными щелочами, в отличие от извести и магнезии.
Нитраты же разлагаются именно до оксидов.
Посмотрел, каустик действительно кипит без разложения, т.е. нагреть до развала сложно.
А вот сода — замечательно разлагается, что бы там «не проходили в школе» )
Греть надо прилично, но не больше, чем для восстановления.
Такое утверждение требует хоть какого-то подтверждения. Приведите источник.
Вики по NaOH, разложение соды до оксида при 1000С
К источникам нужно более критически относиться, особенно к русскоязычной вики — она не более достоверна, чем то, что в школе проходят.
Открываем Stern, K. H.; Weise, E., High temperature properties and decomposition of inorganic salts. US Government Printing Office: 1969., стр. 22 — там приведены энергии Гиббса при разных температурах для реакции Na2CO3 = Na2O + CO2
Реакция становится возможной в диапазоне 2300-2400К — ну за 2000 градусов почти все начинается разваливаться.
Открываем более современную работу Thermal and Carbothermic Decomposition of Na2CO3 and Li2CO3, 2000 год:
//Up to 1200 C, the weight loss of Na2CO3 is 26 pct (3.9 mg), and the reaction is not completed. The decomposition of Na2CO3hasbeenreportedtooccurintwoconsecutive steps:[5,6] Na2CO3 = Na2O (s) + CO2 (g) (l)
Na2O = 2Na (g) + O2 (g) (II) Motzfeldt reported that the Na2O content in Na2CO3 (l) was on the order of 1 mass pct, and the overall rate of decomposition was extremely slow.[5] In the present study, X-ray diffraction (XRD) analyses showed that sample remaining after the experiment was all Na2CO3, and Na2O was not detected.//
Выше 1000 градусов сода потихоньку улетает в виде паров натрия, кислорода и углекислого газа. Никакого оксида натрия не остается.
Более подробное тзображение печи для получения натрия по методу Девиля
http://www.refile.it/mdc/tav28.jpg
Как видно, трубчатые реторты установлены в отражательную печь, и одновременно с получением натрия в ней могут проводиться другие операции (прокаливание, плавление и т.д.). Таким образом должна достигаться значительная экономия на горючем.
На рисунке также хорошо виден хододильник, придуманный Донни и Мареской и обеспечивающий минимальные потери натрия. При получении натрия холодильник устанавливается вертикально, конденсирующийся натрий стекает в подставленную емкость с маслом, а выходящие из него газы (в основном CO) сгорают.
При получении калия холодильник устанавливпется горизонтально, после окончания перегонки весь холодильник помещается в масло и калий вытапливпется осторожным нагревом.
Что там с сайтом происходит? У меня какая то заглушка одно время висела. Причем проукраинская. (живу на дальнем востоке рф)
Я желаю украинцам скорейшего мира, и надеюсь, что сайт продолжит существовать.
Гм. Заглушки быть не должно, видимо хостер ставил когда сайт был перегружен.
Из Австралии сайт больше не доступен, захожу через впн.
Спрошу у провайдеров что такое случилось.
Уж откуда, но из Австралии должно быть ок.
А как будем получать хлорид алюминия?
Подождите, но не этот ли способ пытался воспроизвести Илья Полынков, ютубствующий как ОгненноеТВ ? Способ практически — такой себе. Если есть электричество, то лучше плавить и электролизировать каустическую соду, это он тоже пробовал и успешно.
Получение натрия и калия в небольших количествах
https://upload.wikimedia.org/wikipedia/commons/d/df/Brockhaus_and_Efron_Encyclopedic_Dictionary_b40_675-0.jpg
//The process usually employed in the preparation of sodium is that recommended by SCHOEDLER. The carbonate of soda used is obtained by the ignition of acetate of soda, free access of air being avoided. The object of this is to obtain the carbonate in a very pure state, since, if sulphate of soda be present, it becomes
reduced in the process to sulphide of sodium, which acts strongly on the iron bottle. The mixture of carbonate of soda and charcoal obtained is to be mixed with a fourth of its weight of charcoal in fine powder, and with double this quantity of charcoal in a coarse
state, to prevent fusion of the mass, which, should it occur, the fused contents spirt into the tube, and choke it up. This mixture, heated in the iron bottle, yields pure sodium, with very little black residue. The proportion of sodium obtained by the author of
this process was, from three pounds of thecommercial acetate, about four and a half ounces of sodium; but in the laboratory at Giessen , even when it was obvious that the result was capable of considerable improvement, three pounds of acetate yielded nearly five ounces of sodium, the whole of the sodium present being about seven ounces.//
Три фунта ацетата натрия (~1.5 кг) дают 4.5-5 унций натрия (~150 г).
Капитан Немо тоже пользовался карботермическим методом получения натрия для гальванических батарей, а вернее, топливных элементов, питавших «Наутилус’
//- Вам известен состав морской воды. На тысячу граммов приходится девяносто шесть с половиною процентов чистой воды, два и две трети процента хлористого натрия; далее в небольшом количестве хлористый магний и хлористый кальций, бромистый магний, сернокислый магний, сульфат и углекальциевая соль. Вы видите, что хлористый натрий содержится в морской воде в значительном количестве. Вот этот-то натрий я выделяю из морской воды и питаю им свои элементы.
— Натрием?
— Да, сударь. В соединении с ртутью он образует амальгаму, заменяющую цинк в элементах Бунзена. Ртуть в элементах не разлагается. Расходуется только натрий, а его мне поставляет море. И надо сказать, что, помимо всего, натриевые элементы по крайней мере в два раза сильнее цинковых.
— Я хорошо понимаю, капитан, все преимущество натрия в условиях, в которых вы находитесь. Натрий вам поставляет море. Отлично! Но ведь его еще надо добыть, иначе говоря, выделить из его хлористого соединения. Каким способом вы его извлекаете? Разумеется, ваши батареи могли бы послужить для электрохимического разложения хлористого натрия, но, если не ошибаюсь, расход натрия на электролиз очень высок. И что же окажется? Вы таким способом потратите натрия больше, чем его получите!
— Поэтому-то, господин профессор, я не извлекаю натрий электролитическим способом и пользуюсь для этого энергией каменного угля.
— Каменного угля?
— Скажем, морского угля, если вам угодно, — отвечал капитан Немо.//
Примечательно, что Жюль Верн был практически прав, предположив, что с натриевой амальгамой ЭДС будет в два раза больше, рассчет даёт около 3.5 В по сравнению с обычными элементами Бунзена-Поггендорфа, дающими 1.8-2 В.
ЭДС это хорошо, но вот сколько А*ч на килограмм будет?
Теоретически, с учетом валентности и молярной массы натрия, он должен давать в 1,4 раза больше А/ч, чем цинк
конденсаторы для калия
https://books.google.ru/books/content?id=sFPY0_sFQRQC&hl=ru&pg=PT1&img=1&zoom=3&sig=ACfU3U3AgIp_do85Yj-4bptpTWXs14UHMg&w=1025